Nghiên cứu này đã khảo sát khả năng tích lũy chì của cá da trơn châu Phi khi tiếp xúc với các nồng độ chì khác nhau và sự kết hợp của chì với EDTA. Kết quả cho thấy, EDTA có khả năng làm giảm đáng kể sự tích lũy chì trong các mô của cá, đặc biệt là ở các cơ quan mang, thận và gan. Điều này cho thấy EDTA có tiềm năng trong việc hỗ trợ giải độc chì ở sinh vật thủy sinh.
Giới thiệu
Việc xử lý và quản lý kém các hóa chất độc hại như kim loại nặng ảnh hưởng tiêu cực đến tính toàn vẹn của hệ sinh thái, chất lượng môi trường và sức khỏe con người (Banaee và cộng sự, 2013). Các kim loại nặng như chì, cadmium và thủy ngân không có bất kỳ chức năng sinh học nào trong cơ thể động vật, trong khi các kim loại nặng khác như đồng, kẽm, sắt và crom ở nồng độ thấp lại rất cần thiết cho quá trình trao đổi chất. Tuy nhiên, chúng cũng độc hại nếu vượt quá một phạm vi nồng độ nhất định và có thể ảnh hưởng tiêu cực đến tất cả các bậc dinh dưỡng trong chuỗi thức ăn (Shukla và cộng sự, 2007).
Chì là kim loại nặng được sử dụng rộng rãi trong nhiều ứng dụng công nghiệp khác nhau, như sơn, pin lưu trữ và công nghiệp ô tô, cũng như được tìm thấy tự nhiên trong đất, nước và đá (Khidr và cộng sự, 2012). Chì ở nồng độ cao dẫn đến sự tích tụ trong các mô và cơ quan (Cicik và cộng sự, 2004), thay đổi hành vi (Çiftçi và cộng sự, 2008), chứng loãng xương và bất thường về sắc tố (Martinez và cộng sự, 2004), suy giảm hệ thống miễn dịch ở cá (Vosylienė, 1999) và các tác động gây đột biến, gây quái thai, gây ung thư và vô sinh ở người (Eisler, 2000).
Các phức chất hữu cơ và vô cơ như EDTA, NTA (axit Nitrilotriacetic), DTPA (axit Diethylenetriamine pentaacetic), DFO (Deferoxamine), DFP (Deferipron), zeolite, clinoptilolite và chitosan, được sử dụng rộng rãi trong các hệ thống thủy sinh để loại bỏ các chất ô nhiễm khỏi môi trường. môi trường. Khả năng tạo phức chất cao với kim loại nặng và khả năng phân hủy sinh học thấp trong hệ thống thủy sinh là những đặc tính chính của hóa chất được sử dụng làm chất chelat (Kedziorek và Bourg, 2000).
Ở cá, gan tích tụ kim loại ở nồng độ cao bất kể đường hấp thụ và do lượng kim loại trong gan gần bằng với nồng độ kim loại trong môi trường nên việc theo dõi ô nhiễm kim loại trong hệ sinh thái dưới nước là rất quan trọng (Jezierska). và Witeska, 2006). Mang, có chức năng quan trọng như hô hấp và điều hòa thẩm thấu, là cơ quan mục tiêu chính của các hóa chất độc hại vì chúng tương tác trực tiếp với môi trường (Poleksic và Mitrovic-Tutundzic, 1994). Ở cá, thận có chức năng duy trì cân bằng nội môi, cũng như loại bỏ các chất thải trao đổi chất có chứa nitơ và các chất độc hại ra khỏi cơ thể (Cengiz, 2006). Não là một cơ quan hoạt động trao đổi chất rất nhạy cảm với những thay đổi trong quá trình chuyển hóa năng lượng (Soengas và Aldegunde, 2002). Mặc dù mô cơ ở cá không hoạt động tích lũy kim loại nhưng nó là bộ phận tiêu hao chính của cá và có chức năng truyền kim loại sang con người qua chuỗi thức ăn nên rất quan trọng về mặt môi trường và sức khỏe con người (Jezierska và Witeska, 2006).
Mặc dù đã có nhiều nghiên cứu về tích lũy và ảnh hưởng độc hại của kim loại nặng đến sinh vật thủy sinh, các nghiên cứu về ảnh hưởng của các chất tạo phức đến độc tính kim loại nặng còn hạn chế. Do đó, nghiên cứu này nhằm mục đích xác định mức độ tích lũy chì và tích lũy chì cùng với EDTA trong các mô gan, mang, thận, não và cơ của C. gariepinus trong thời gian bảy, mười lăm và ba mươi ngày.
Vật liệu và phương pháp
Nghiên cứu được thực hiện trong phòng thí nghiệm nghiên cứu khoa học cơ bản của Đơn vị Ứng dụng Khoa Thủy sản thuộc Đại học Mersin trong điều kiện môi trường xung quanh được kiểm soát (nhiệt độ cố định 24±1 oC, chu kỳ sáng 12 giờ tối/12 giờ ánh sáng ban ngày, hệ thống thông gió trung tâm).
Mẫu C. gariepinus có trọng lượng 68,17 ±4,36 g và 21,24, Tổng chiều dài ± 2,08 cm được sử dụng làm vật liệu trong thí nghiệm. Cá được cho ăn một lần mỗi ngày vào cùng một giờ bằng thức ăn cho cá thương mại (Pellet số 2, Pınar, İzmir, Thổ Nhĩ Kỳ) với tỷ lệ 2% tổng sinh khối của chúng trong suốt nghiên cứu. Muối hòa tan trong nước của chì, Pb(NO3)2, được sử dụng trong nghiên cứu, trong khi EDTA (C10H16N2O8) được sử dụng làm tác nhân tạo phức. Theo kết quả của các nghiên cứu tài liệu (Alkahemal-Balawi và cộng sự, 2011; Bawa-Allah và Saliu, 2015) và các nghiên cứu sơ bộ, nồng độ không gây chết người của cả chì và EDTA (1,0 và 2,0 ppm Pb; 2,0 và 4,0 ppm EDTA ) trong khoảng thời gian quy định đã được xác định và sử dụng. Năm bể kính đã được sử dụng trong nghiên cứu để chứa 120 L mỗi dung dịch thử nghiệm. Các giải pháp ở nồng độ chì 1,0 và 2,0 ppm lần lượt được thêm vào hai bể cá đầu tiên. Đối với bể cá thứ ba và thứ tư, dung dịch chì 1,0 ppm với EDTA 2,0 ppm và Chì 2,0 ppm với EDTA 4,0 ppm được thêm vào tương ứng. Bể cá thứ năm chứa 120 L nước máy không chì và tạo thành bể đối chứng. Các thí nghiệm được thực hiện trong ba lần lặp lại và hai con cá được sử dụng trong mỗi lần lặp lại. Sáu con cá được đưa ra khỏi mỗi bể cá ở cuối chiều dài bảy, mười lăm- , và thời gian ba mươi ngày và được gây mê bằng phenoxy-etanol (1 ml/L) (Morgan và cộng sự, 1997), và các mô gan, mang, thận, não và cơ của cá được mổ xẻ riêng biệt. Tổng cộng, 90 con cá đã được sử dụng trong thí nghiệm. Tất cả các hướng dẫn quốc tế, quốc gia và/hoặc tổ chức hiện hành về việc chăm sóc và sử dụng động vật đều được tuân thủ. Đã nhận được phê duyệt của ủy ban đạo đức địa phương.
Bảng 1. Một số tính chất lý hóa của nước trong bể nuôi thí nghiệm

Do các dung dịch thử nghiệm trong bể cá chịu sự thay đổi phụ thuộc vào thời gian về nồng độ của chúng do sự bay hơi, kết tủa và bám dính trên bề mặt nên thử nghiệm bán tĩnh đã được áp dụng và các dung dịch thử nghiệm được thay mới hai ngày một lần bằng các độ pha loãng thích hợp của dung dịch thử nghiệm. giải pháp chứng khoán.
Các mẫu gan, mang, thận, não và mô cơ đã được mổ xẻ và sử dụng trong phân tích kim loại. Các mẫu được đặt trong lò sấy ở nhiệt độ 105 oC trong 72 giờ cho đến khi đạt được trọng lượng cố định. Sau đó, hỗn hợp gồm 2 ml axit nitric (HNO3, 65%, trọng lượng riêng 1,40, Merck) và 1 ml axit perchloric (HClO4, 60%, trọng lượng riêng 1,53, Merck) (Muramoto, 1983) được thêm vào bộ đĩa nóng ở 120 oC trong 8 giờ. Sau quá trình đốt, các mẫu mô được chuyển vào ống polyetylen, tổng thể tích của chúng được điều chỉnh thành 10 ml bằng nước khử ion và sẵn sàng để phân tích. Hàm lượng chì trong các mẫu mô được xác định bằng ICP-MS. Phân tích được thực hiện trong ba lần. Mẫu đối chứng được chuẩn bị từ IAEA ˗ 407 (Cơ quan Năng lượng Nguyên tử Quốc tế) chất đồng nhất mô cá. Kết quả chi tiết về lượng nguyên tố chì thu được từ vật liệu tham chiếu và các giá trị LOD-LOQ được đưa ra trong Bảng 2. Phân tích phương sai và bài kiểm tra của Sinh viên Newman Keul (SNK) được thực hiện bằng cách sử dụng chương trình gói SPSS để phân tích thống kê dữ liệu.
Bảng 2. Các thông số xác nhận của phương pháp phân tích.
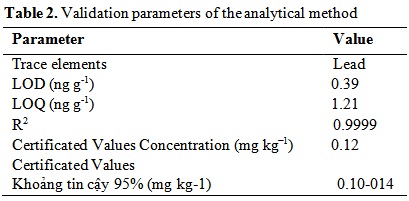
Lưu ý: IAEA-407 được sử dụng làm tài liệu tham khảo. LOD= Giới hạn phát hiện, LOQ= Giới hạn định lượng.
Trong nghiên cứu hiện tại về C. gariepinus, không quan sát thấy cá chết do ảnh hưởng của thời gian và nồng độ xác định. Khi bắt đầu thí nghiệm, người ta đã quan sát thấy nhiều thay đổi về hành vi và hình thái ở cá, bao gồm thiếu chất dinh dưỡng, bất động ở đáy bể, hướng về phía bề mặt bể và sẫm màu da.
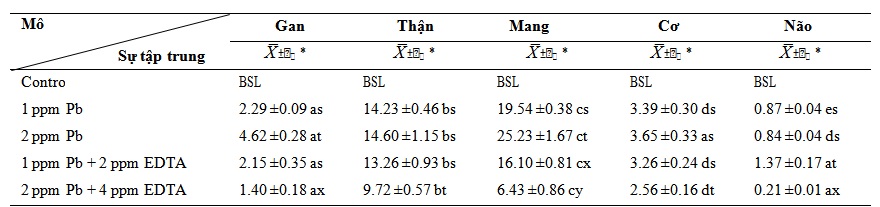
Tác động của nồng độ chỉ có chì sau bảy ngày là tăng tích lũy kim loại trong các mô và cơ quan được kiểm tra khi so sánh với đối chứng (p<0,05, Bảng 3). Vào cuối ngày thứ 7, mức tích lũy cao nhất ở mô mang, còn mức tích lũy thấp nhất ở mô cơ. Tác dụng của nồng độ chì cao kết hợp với EDTA là làm giảm sự tích tụ chì trong các mô và cơ quan được kiểm tra, so với tác dụng của chỉ dùng chì (p<0,05).
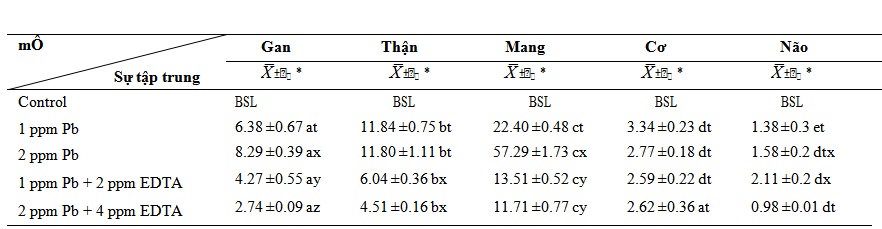
Tác động của nồng độ chỉ có chì ở mức 1,0 và 2,0 ppm trong mười lăm ngày đã làm tăng sự tích lũy kim loại trong tất cả các mô khi so sánh với đối chứng (Bảng 4). Sự gia tăng này cao hơn đáng kể ở các mô gan và mang khi so sánh với ngày thứ 7 (p<0,05). Tác dụng của hỗn hợp chì và nồng độ EDTA cao trong mười lăm ngày dẫn đến giảm khoảng 60% sự tích tụ chì trong các mô gan, thận và mang khi so sánh với tác động của chỉ nồng độ chì cao.
Bảng 3. Sự tích lũy chì ở C. gariepinus dưới tác dụng duy nhất của chì và cùng với EDTA trong 7 ngày (µgPb/g d.w.)
Bảng 4. Chỉ tích lũy chì và chì cùng với EDTA trong mô C. gariepinus trong 15 ngày (µgPb/g d.w.)
Bảng 5. Sự tích lũy chì ở C. gariepinus dưới tác dụng duy nhất của chì và dưới chì cùng với EDTA trong 30 ngày (µgPb/g d.w.)
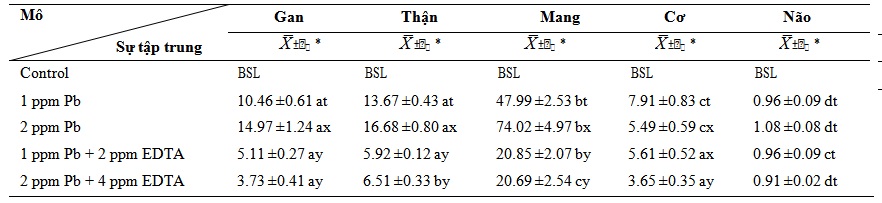
Ghi chú: X̅ ± 𝑆𝑥̅ = Trung bình cộng ± Sai số chuẩn; BSL = Dưới mức độ nhậy
* = SNK; a, b, c, d, e được sử dụng để xác định sự khác biệt giữa các mô trong khi s, t, x và y được sử dụng để xác định sự khác biệt giữa các nồng độ. Các chữ cái khác nhau biểu thị sự khác biệt thống kê ở P <0, 05
Thảo luận
Tác dụng của chì ở nồng độ cao hơn cùng với EDTA trong 30 ngày làm tăng đáng kể sự tích tụ chì trong các mô và cơ quan được kiểm tra so với đối chứng và đến ngày 7 và 15 (p<0,05) (Bảng 5). Trong khi sự gia tăng này song song với sự gia tăng nồng độ chì, tác dụng của chì cùng với EDTA làm giảm sự tích tụ kim loại trong các mô được kiểm tra khi so sánh với tác dụng của chỉ chì. Sự giảm này diễn ra song song với sự gia tăng nồng độ.
Tác động của các chất độc hại, đặc biệt là kim loại nặng, đến tỷ lệ tử vong và thời gian tử vong ở động vật có xương sống dưới nước khác nhau tùy thuộc vào loài, kim loại, nồng độ môi trường của kim loại và thời gian tiếp xúc. Trong các nghiên cứu được thực hiện trên nhiều loài cá khác nhau, người ta xác định rằng tỷ lệ tử vong tăng song song với sự gia tăng nồng độ độc tố trong môi trường và thời gian phơi nhiễm (Abdullah và cộng sự, 2007; Gül và cộng sự, 2009; Alkahemal -Balawi và cộng sự, 2011). Trong nghiên cứu hiện tại được tiến hành trên C. gariepinus, không quan sát thấy cá chết trong các điều kiện về thời gian và nồng độ áp đặt. Điều đó có thể được giải thích là do nồng độ chì được tìm thấy trong các mô không gây tử vong cho loài đối tượng trong những khoảng thời gian nhất định.
Cá phản ứng bằng cách thay đổi hành vi của chúng trước những thay đổi của điều kiện môi trường như ô nhiễm hoặc thay đổi tính chất vật lý hoặc hóa học của nước. Những thay đổi đó bao gồm các hành vi như kiếm ăn, sinh sản, tăng trưởng, hô hấp và vận động (Alves và Wood, 2006). Trong nghiên cứu này được thực hiện với C. gariepinus, những thay đổi về hành vi như thờ ơ với thức ăn, bất động ở đáy bể cá, rối loạn phối hợp trong các động tác bơi lội và khó khăn về hô hấp đã được quan sát thấy khi bắt đầu có hiệu ứng chì và những thay đổi này biến mất cùng với sự kéo dài về thời gian tác dụng. Những thay đổi quan sát được trong hành vi của cá khi bắt đầu có hiệu ứng kim loại có thể là kết quả của phản ứng với các điều kiện môi trường thay đổi, trong khi việc kéo dài thời gian tác động và trở lại hành vi bình thường có thể liên quan đến sự thích nghi.
Trong các nghiên cứu được thực hiện với nhiều loài cá khác nhau trong cả điều kiện tự nhiên và phòng thí nghiệm, người ta thấy rằng sự tích lũy kim loại khác nhau tùy theo mô và cơ quan (Alves và Wood, 2006; Shukla và cộng sự, 2007; Banaee và cộng sự, 2013; Ogbuagu và cộng sự cộng sự, 2015). Gan là một cơ quan quan trọng có chức năng giải độc và biến đổi sinh học các chất xenobiotic, cũng như trong các quá trình trao đổi chất (Van Dyk và cộng sự, 2007). Người ta xác định rằng cadmium trong Oreochromis aureus (Gül và cộng sự, 2009), chì trong Oncorhynchus mykiss (Alves và Wood, 2006), và kẽm, cadmium và đồng trong Channa punctatus (Shukla và cộng sự, 2007) tích lũy nhiều hơn trong gan hơn ở các mô và cơ quan khác. Trong nghiên cứu hiện tại được thực hiện với C. gariepinus, sự tích lũy cao nhất xảy ra ở các mô mang và thận, tiếp theo là mô gan, dưới tác dụng duy nhất của chì. Điều đó có thể là do gan chịu trách nhiệm về quá trình giải độc và nồng độ chì không vượt quá khả năng hấp thu và vận chuyển của nó (Figueiredo-Fernandes và cộng sự, 2006; Van Dyk và cộng sự, 2007).
Ở cá, mang tham gia vào quá trình hô hấp, điều hòa thẩm thấu và chức năng bài tiết. Người ta xác định rằng chì tích lũy nhiều nhất trong mô mang ở Carassius auratus (Banaee và cộng sự, 2013), C. gariepinus (Kusemiju và cộng sự, 2012) và C. catla (Mohanambal và Puvaneswari, 2013), trong khi kẽm, đồng và cadmium tích lũy nhiều nhất trong mô mang ở C. punctatus (Shukla và cộng sự, 2007) dưới tác dụng của về nồng độ dưới mức gây chết. Trong nghiên cứu này được thực hiện với C. gariepinus cho thấy chì tích lũy ở mô mang nhiều hơn ở các mô thận, gan, não và cơ dưới tác dụng của chỉ chì hoặc chì kết hợp với EDTA trong khoảng thời gian và nồng độ xác định. . Sự tích tụ cao này trong mô mang có thể liên quan đến mang tương tác trực tiếp với môi trường. Chức năng của mang trong bài tiết cũng như hô hấp và điều hòa áp suất thẩm thấu (Poleksic và Mitrovic-Tutundzic, 1994; Mazon và cộng sự, 2002), và việc giữ lại các ion chì bằng cách liên kết chúng với màng nhầy bao phủ bề mặt mang là một cơ chế bảo vệ cơ chế (Tao và cộng sự, 2000).
Thận là một cơ quan đa chức năng bao gồm các chức năng tạo máu, lưới nội mô, nội tiết và bài tiết ở cá xương (Karaman và Dörücü, 2017). Trong các nghiên cứu được thực hiện với Prochilodus lineatus (Ribeiro và cộng sự, 2014), Tilapia zilli (Karataş và Kalay, 2002) và Cyprinus carpio (Luszczek-Trojnar và cộng sự, 2016), chì tích tụ nhiều nhất trong các mô thận. Mặt khác, trong một nghiên cứu được thực hiện với các loài được đề cập (Al -Balawi và cộng sự, 2013) và trong nghiên cứu này, người ta phát hiện thấy chì tích tụ nhiều nhất ở mô mang, tiếp theo là mô thận. Điều đó có thể là do kim loại được vận chuyển đến mô thận để đào thải ra khỏi cơ thể (Clearwater và cộng sự, 2002) và được giữ lại bằng cách liên kết với các protein liên kết kim loại như metallicothionein trong thận (Alves và Wood, 2006).
Không giống như các kim loại khác, chì được phát hiện có thể đi qua hàng rào máu não và tích tụ ở nồng độ cao trong mô não bằng cách ức chế hoạt động của monoamine oxidase và acetylcholine esterase (Eisler, 2000). Nó cũng ức chế chức năng dẫn truyền thần kinh bằng cách giảm nồng độ axit gamma-aminobutyric, cholesterol và lipid (Katti và Sathyanesan, 1986). Trong một nghiên cứu được thực hiện với cá rô phi nilotica và C. carpio, người ta phát hiện ra rằng chì
tích tụ trong cả hai loại mô não với nồng độ cao hơn cadmium, niken và crom (Canlı và Kargın, 1995). Như trong các nghiên cứu về O. mykiss (Alves và Wood, 2006) và C. catla (Mohanambal và Puvaneswari, 2013), sự tích lũy chì trong nghiên cứu hiện tại được thực hiện với C. gariepinus ở mô não thấp hơn ở mang, gan, và mô thận dưới tác dụng của nồng độ dưới mức gây chết. Sự tích tụ thấp hơn trong mô não có thể liên quan đến hàng rào máu não, chuyển hóa kim loại và khả năng vận chuyển của các mô (Eisler, 2000; Alves và Wood, 2006).
Trong các nghiên cứu được thực hiện dưới nhiều loài cá và điều kiện phòng thí nghiệm (Canlı và Kargın, 1995; Alves và Wood, 2006; Kusemiju và cộng sự, 2012; Mohanambal và Puvaneswari, 2013), người ta đã xác định rằng sự tích lũy chì tối thiểu trong mô là ở mô cơ. Trong nghiên cứu này, cả dưới tác dụng của chì và chì kết hợp với EDTA, mức độ tích lũy ở mô cơ thấp nhất so với các mô và cơ quan khác. Mức độ tích tụ thấp hơn trong mô cơ có thể liên quan chặt chẽ đến chức năng trao đổi chất của mô hoặc thời gian tiếp xúc với sự tích tụ ngắn hơn.
Các chất chelat tạo thành phức chất với kim loại nặng trong môi trường bằng cơ chế hấp phụ và trao đổi ion, ngăn chặn sự hấp thụ và tích lũy của chúng bởi sinh vật dưới nước và làm giảm tác dụng độc hại của chúng. Ở C. carpio, sự tích tụ chì trong các mô và cơ quan được kiểm tra dưới tác dụng duy nhất của chì và chì cùng với EDTA, NTA và DTPA; với các chất chelat, sự tích tụ chì trong các mô đã giảm so với tác dụng của chỉ chì (Muramoto, 1980). Người ta xác định rằng canxi làm giảm sự tích tụ chì trong mô ở O. mykiss (Alves và Wood, 2006) và sự tích lũy đồng trong mô ở O. rêuambicus (James et al., 1998) so với chỉ tác dụng của kim loại. Trong nghiên cứu hiện tại được thực hiện với C. gariepinus, tác dụng của chì cùng với EDTA trong thời gian và nồng độ thí nghiệm làm giảm sự tích tụ chì trong các mô và cơ quan được kiểm tra so với tác dụng của chỉ chì. Tác dụng của chất chelat có thể là do giảm tích lũy, phức hợp EDTA với chì, tăng kích thước phân tử và ngăn cản sự hấp thu (Shalaby, 2007).
Phần kết luận
Kết quả là cả tác động của chì và chì cùng với EDTA ở C. gariepinus đều gây ra sự tích tụ chì trong mang, gan, thận, não và các mô cơ. Sự tích tụ chì cao nhất ở mô mang, trong khi thấp nhất ở mô cơ. Tác dụng của chì với EDTA làm giảm sự tích tụ kim loại trong các mô được kiểm tra khi so sánh với tác dụng của chỉ chì. Vì vậy, người ta kết luận rằng, ở C. gariepinus, mô mang là cơ quan chỉ thị xác định độc tính của chì và EDTA có tác dụng làm giảm độc tính của chì.
Nguồn: BQ&Q tổng hợp và dịch từ Fahri Karayakar, Adeviye Yavuz, Bedii Cicik (Đại học Mersin, Khoa Thủy sản, Mersin, Thổ Nhĩ Kỳ)
EDTA Disolvine na2 và Disolvine na từ Nouryon Hà Lan là những sản phẩm EDTA chất lượng cao, được sản xuất trên dây chuyền công nghệ hiện đại và tuân thủ các tiêu chuẩn nghiêm ngặt. Với khả năng tạo phức bền vững với các ion kim loại, các sản phẩm này không chỉ mang lại hiệu quả sử dụng tối đa mà còn góp phần làm giảm độc tính, đáp ứng nhu cầu đa dạng của các ngành công nghiệp.
Hiện Công ty Cổ phần BQ&Q đang Đại diện thương mại cho 2 sản phẩm Disolvine Na2 và Disolvine Na tại thị trường Việt Nam. Quý khách hàng có nhu cầu, vui lòng liên hệ 1900 9030 để được tư vấn và hỗ trợ đặt hàng.





