Sự xuất hiện của bệnh ở tôm đã gây ra nhiều lo ngại về an toàn và an ninh thực phẩm cho người tiêu dùng với các báo cáo gần đây về bệnh vi bào tử trùng gan tụy (HPM) do Enterocytozoon hepatopenaei (EHP) gây ra. Vi bào tử trùng có trong tôm vẫn là tác nhân gây bệnh thầm lặng ngăn cản sự phát triển tối ưu của tôm. Tuy nhiên, mối đe dọa lớn nhất nằm ở các mối quan tâm về an toàn thực phẩm, đây là trọng tâm chính trong việc đảm bảo an ninh sinh học và an toàn sinh học thực phẩm. Do đó, mục tiêu của bài đánh giá này là tóm tắt kiến thức hiện tại về EHP và tình trạng nhiễm trùng của nó ở tôm với các mối quan tâm về an toàn thực phẩm. Bài báo này cung cấp một phân tích về các phương pháp chẩn đoán để phát hiện nhiễm trùng EHP trong nuôi tôm. Các can thiệp bằng sinh học phân tử và công nghệ sinh học hiện tại sẽ là cách tiếp cận thứ hai để giải quyết các bệnh EHP. Cuối cùng, một hướng dẫn có hệ thống về an toàn thực phẩm cho tôm bằng cách sử dụng chẩn đoán và can thiệp được đề xuất. Do đó, bài đánh giá này nhằm mục đích làm sáng tỏ các phương pháp hiệu quả để chẩn đoán và ngăn ngừa nhiễm trùng EHP ở tôm. Chúng tôi cũng đưa thông tin về các công cụ phân tử và hệ gen cũng như các phân tử sinh học miễn dịch bẩm sinh làm mục tiêu trong tương lai trong các chiến lược can thiệp vào vòng đời của bệnh vi bào tử trùng ở tôm và môi trường của nó. Nhìn chung, điều này sẽ dẫn đến việc giảm các đợt bùng phát dịch bệnh trong nuôi tôm, đảm bảo an toàn thực phẩm cho tôm trong tương lai.
1. Giới thiệu
Nuôi tôm là một ngành kinh doanh nuôi nhiều loại tôm biển và tôm càng xanh để làm thực phẩm cho con người, trong đó tôm nuôi hiện chiếm hơn một nửa tổng nguồn cung tôm trên thế giới [1]. Theo Quỹ Động vật hoang dã Thế giới (WWF), 80% hoạt động nuôi tôm do hai loài tôm họ Penaeid là Penaeus monodon (tôm sú khổng lồ) và Penaeus vannamei (tôm chân trắng) chi phối [2]. Trước năm 2000, loài tôm được nuôi rộng rãi nhất ở Châu Á là Penaeus monodon, và điều này bắt đầu thay đổi vào thời điểm đó, khi tôm Penaeus vannamei thuần hóa và không có mầm bệnh cụ thể (SPF) trở thành loài được người nuôi tôm trên toàn thế giới ưa chuộng [3]. Tuy nhiên, sự gia tăng dịch bệnh ở tôm đã đặt ra câu hỏi về tính bền vững của hoạt động nuôi tôm, vốn đã trở thành rào cản đối với hoạt động sản xuất tôm nuôi trên toàn thế giới [4]. Một căn bệnh mới nổi, bệnh vi bào tử trùng gan tụy (HPM) do Enterocytozoon hepatopenaei (EHP) gây ra, đã gây ra mối lo ngại trong ngành nuôi tôm. Bệnh này được đặt tên là HPM chủ yếu vì cơ quan đích của EHP là gan tụy, trong đó vi bào tử trùng lây nhiễm các tế bào biểu mô ống gan tụy của giáp xác bằng cách thay đổi các thông số sinh hóa như albumin, aspartate transaminase (AST), aspartate transaminase (ALT) và phosphatase kiềm [4]. HPM gây chậm phát triển và chênh lệch kích thước lớn ở tôm nuôi, khiến tác nhân gây bệnh, EHP, trở thành tác nhân gây bệnh đáng lo ngại về mặt kinh tế trong nuôi tôm [5].
EHP là một loại ký sinh trùng đơn bào, chuyên biệt, hình thành bào tử ở người, động vật, côn trùng và giáp xác, thuộc họ Enterocytozoonidae và ngành Microsporidia [6,7]. Nhiễm trùng EHP làm chậm sự phát triển của tôm nhưng không gây tử vong hoặc các dấu hiệu bệnh rõ ràng [8]. Tuy nhiên, nhiễm trùng EHP ngăn cản sự phát triển tối ưu của tôm, dẫn đến thiệt hại kinh tế cho đất nước. Hơn nữa, EHP sinh sôi trong tế bào chất của các tế bào bị nhiễm bệnh và mô bệnh học của tôm bị nhiễm EHP cho thấy các thể vùi ưa kiềm không đều hoặc đều đặn trong tế bào chất, bất kể sự hiện diện của bào tử [9]. Cho đến nay, vẫn chưa có phương pháp điều trị nào có thể chữa khỏi vấn đề này do EHP gây ra ở tôm, vì EHP tạo ra các bào tử có khả năng kháng thuốc cao và ổn định [4]. Do đó, vấn đề này có thể ảnh hưởng đến an toàn thực phẩm, vì tôm là một loại hải sản có thể gây bệnh cho người khi tiêu thụ.
Do đó, bài đánh giá này tóm tắt chẩn đoán HPM do EHP gây ra liên quan đến các vấn đề về an toàn thực phẩm với các thảo luận sâu hơn về việc giải quyết các bệnh do EHP bằng cách sử dụng sinh học phân tử hiện tại và đề xuất một hướng dẫn có hệ thống về an toàn thực phẩm cho tôm bằng cách sử dụng các công cụ chẩn đoán và can thiệp.
2. Phương pháp chẩn đoán EHP
2.1. Bệnh học mô học
2.1.1. Kính hiển vi
EHP có thể được chẩn đoán bằng phương pháp kính hiển vi sử dụng các lát cắt mô nhuộm hematoxylin-eosin (H&E). Phương pháp này có thể được thực hiện bằng cách quan sát cẩn thận các bào tử trong mô gan tụy và mẫu phân bằng cách sử dụng phân tích kính hiển vi [4]. Đối với phân tích kính hiển vi quang học, gan tụy tôm cần được cố định trong chất cố định như chất cố định Davidson, xử lý để làm mô học và nhuộm bằng H&E [10]. Phân tích bệnh học mô học của nhiễm trùng EHP cho thấy các giai đoạn sống của EHP trong các tế bào biểu mô ống gan tụy (HP) và các bào tử tự do đã được giải phóng vào lòng ống HP từ các tế bào biểu mô bị phân hủy [6]. Điều này đã được chứng minh bằng một nghiên cứu [10] trong đó phân tích mô học cho thấy các giai đoạn sống của EHP, bào tử trưởng thành và biểu mô hoại tử nghiêm trọng và các ống HP như thể hiện trong Hình 1.
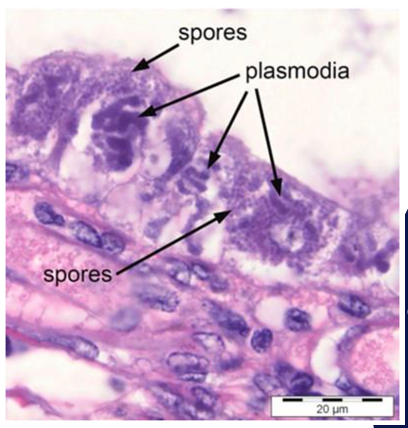
Mô HP nhuộm H&E cho thấy bào tử EHP và ký sinh trùng
Tuy nhiên, độ nhạy của phương pháp H&E không đạt tiêu chuẩn trong kế hoạch phòng ngừa EHP vì bào tử không thể dễ dàng phân biệt với tế bào vật chủ bình thường trong các trường hợp nhiễm trùng cấp độ thấp [6,11]. Do đó, cần phát triển phương pháp lai tại chỗ (ISH) để xác nhận kết quả thu được.
2.1.2. Lai tạo tại chỗ (ISH)
Đầu dò gen 18SrRNA gắn nhãn DIG được sử dụng trong các xét nghiệm ISH để xác định EHP, vì nó cho phép đánh giá mức độ nghiêm trọng của nhiễm trùng vì có thể nhìn thấy tất cả các giai đoạn sống của EHP, ngay cả ở mức độ phóng đại thấp [11,12]. Ngoài ra, ISH được báo cáo là nhạy hơn và chính xác hơn trong việc phát hiện tác nhân gây bệnh, vì các tế bào không có bằng chứng nhìn thấy được về bào tử vi bào tử từ phân tích mô học có thể được xác định là dương tính [12] như thể hiện trong Hình 2.
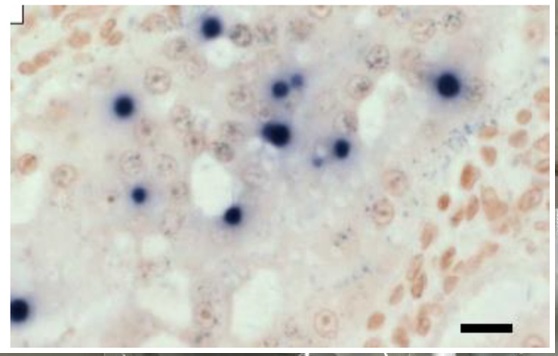
Lai tạo tại chỗ mô HP của Penaeus vannamei với đầu dò EHP gắn digoxigenin [13]. Thanh tỷ lệ = 25 µm.
Tuy nhiên, các kỹ thuật ISH phức tạp không phù hợp để sử dụng thực tế trong trang trại vì chúng tốn thời gian và không đủ thực tế để sử dụng như một phương pháp thường xuyên để phát hiện EHP.
2.2. Phương pháp phát hiện phân tử
2.2.1. Phản ứng chuỗi polymerase (PCR)
PCR vẫn là một kỹ thuật phổ biến được sử dụng trong chẩn đoán bệnh tôm vì nó đơn giản hơn và tiết kiệm chi phí hơn. Các loại phương pháp PCR được sử dụng để phát hiện EHP là PCR một bước [14], qPCR [15] và PCR lồng nhau [5]. Trong trường hợp này, PCR một bước dễ thực hiện hơn và chỉ cần một bộ mồi; tuy nhiên, ngưỡng phát hiện thường thay đổi từ 1000 đến 10.000 bản sao cho mỗi phản ứng, không đủ để phát hiện sự lây lan nhiễm trùng qua vật mang mầm bệnh [6]. Trong một nghiên cứu được tiến hành về việc phát triển xét nghiệm PCR để phát hiện hiệu quả EHP và điều tra tình trạng phổ biến của EHP ở tỉnh Sơn Đông, Trung Quốc, một cặp mồi khuếch đại 358 cặp bazơ của một đoạn DNA EHP đã được thiết kế và cho thấy có khả năng phát hiện EHP ở số lượng bản sao thấp tới 2 × 101 [14]. Phương pháp này được báo cáo là nhạy hơn và đặc hiệu hơn so với các xét nghiệm PCR EHP trước đây. Hơn nữa, xét nghiệm PCR mới được phát triển có thể được sử dụng để xác định EHP trong nhiều mẫu tôm một cách kịp thời và hiệu quả.
Trong khi đó, PCR lồng nhau sử dụng hai bộ mồi để khuếch đại mục tiêu liên tiếp, mang lại độ nhạy ít nhất gấp 10 lần so với một bước tương đương của nó [6]. Do đó, điều này dẫn đến khả năng phát hiện nhiễm trùng ở mức độ thấp. Vì các phương pháp PCR hiện có nhắm mục tiêu vào rRNA SSU của EHP được phát hiện là đưa ra kết quả xét nghiệm dương tính giả do phản ứng chéo của các mồi SSU-PCR với DNA từ các vi bào tử trùng có quan hệ gần, nên phương pháp PCR lồng nhau đã được phát triển để phát hiện gen protein thành bào tử (SWP) của EHP [5]. Phương pháp PCR lồng nhau này được phát hiện là phân biệt thành công EHP và không đưa ra kết quả dương tính giả từ các vi bào tử trùng có quan hệ gần. Do đó, nên thiết kế các ứng dụng PCR xung quanh gen SWP hoặc các gen có tính đa dạng trình tự cao ở vi bào tử trùng thủy sinh. Hơn nữa, một phương pháp PCR lồng nhau đã được sửa đổi để phát hiện EHP ở Macrobrachium rosenbergi, tôm càng xanh đã được thực hiện trong đó các mồi được thiết kế lại để phát hiện chủng EHP riêng biệt. Điều này là do các đoạn mồi trước đây không thể khuếch đại gen EHP SWP1; do đó, phương pháp SWP-PCR lồng nhau đã được thay đổi và các đoạn mồi mới cho thấy độ đặc hiệu và độ nhạy cao [16]. Nhìn chung, phương pháp của nghiên cứu này được đề xuất là có lợi cho việc điều tra các đột biến EHP trong các nghiên cứu dịch tễ học và đột biến gen SWP1 cho phép hiểu rõ hơn về các cơ chế phân tử mà EHP thích nghi với nhiều vật chủ khác nhau.
Ngoài ra, qPCR, là một phương pháp định lượng, được yêu cầu để đánh giá mức độ nghiêm trọng của nhiễm trùng và sự tiến triển của bệnh vì qPCR được sử dụng để định lượng tác nhân gây bệnh dựa trên mối quan hệ tuyến tính giữa logarit của số bản sao mẫu và số chu kỳ PCR cần thiết để đạt được ngưỡng [6,17]. Trong một nghiên cứu được tiến hành để phát hiện và định lượng EHP ở tôm bị nhiễm bệnh Litopenaeus vannamei, một xét nghiệm qPCR huỳnh quang SYBR Green I đã được thiết kế dựa trên gen protein ống phân cực 2 (PTP2) [15]. Nghiên cứu cho thấy hiệu quả khuếch đại là 102% và kỹ thuật qPCR được xác định là có độ nhạy, độ đặc hiệu và khả năng lặp lại cao. Tuy nhiên, nhược điểm cơ bản của qPCR và các biến thể của nó là cần thiết bị qPCR đắt tiền, xử lý chất lỏng đáng kể và nhân viên có chuyên môn về sinh học phân tử tiên tiến [6].
2.2.2. Khuếch đại polymerase tái tổ hợp (RPA)
RPA là một kỹ thuật khuếch đại đẳng nhiệt nhanh và đơn giản. Kỹ thuật này có thể khuếch đại DNA trong thời gian phản ứng ngắn hơn và chỉ cần một cặp mồi [6]. Ngoài ra, RPA cũng là một công nghệ phát hiện tại chỗ đáng tin cậy và hiệu quả [6,18]. Một xét nghiệm RPA thời gian thực đã được thiết lập bằng cách kết hợp phân tích huỳnh quang với hệ thống RPA để phát hiện nhanh tình trạng nhiễm EHP ở tôm [18]. Theo kết quả nghiên cứu, việc phát hiện được thực hiện trong 10 phút với độ đặc hiệu tốt khi sử dụng kỹ thuật này và kết quả phát hiện đối với các mẫu lâm sàng thực tế phù hợp 100% với kỹ thuật PCR lồng nhau đã được thiết lập [18]. Nhìn chung, xét nghiệm RPA có thể được sử dụng rộng rãi để phát hiện tình trạng nhiễm EHP ở các vùng xa xôi vì nó đơn giản và đáng tin cậy.
2.2.3. Khuếch đại đẳng nhiệt qua vòng lặp (LAMP)
Xét nghiệm LAMP phát hiện EHP nhanh chóng với nhiệt độ phản ứng không đổi và bằng cách sử dụng bồn tắm khô đơn giản mà không yêu cầu bất kỳ chuyên môn kỹ thuật hoặc thiết bị tốn kém nào như máy tuần hoàn nhiệt [6,19]. Gần đây, một xét nghiệm chẩn đoán EHP LAMP đo màu cải tiến đã được phát triển với các đoạn mồi đặc hiệu cho gen protein thành bào tử EHP (SWP) để phát hiện trực quan EHP [19]. Trong nghiên cứu này, thuốc nhuộm xanh hydroxy naphthol (HNB) hoặc đỏ phenol đã được sử dụng để đạt được khả năng phát hiện trực quan các amplicon LAMP mà không cần mở ống để tránh nhiễm bẩn. Hơn nữa, xét nghiệm LAMP EHP cho thấy độ nhạy 95,31%, độ đặc hiệu 98,98% và giá trị kappa là 0,948 so với tiêu chuẩn vàng, SWP-PCR [20]. Do đó, xét nghiệm LAMP thân thiện với người dùng và có tiềm năng lớn để thực hiện tại các trang trại. Bảng 1 hiển thị tất cả các đoạn mồi được sử dụng trong các kỹ thuật phát hiện phân tử ở EHP.
Bảng 1.
Danh sách trình tự mồi được sử dụng trong phát hiện phân tử EHP ở tôm.
| Phương pháp | Tên mồi | Trình tự mồi (5′–3′) | Reference |
One-step PCR
SSU rRNA |
EHP-510F | GCCTGAGAGATG GCTCCCACGT | [12] |
| EHP-510R | GCGTACTATCCCCAGAGCCCGA | ||
qPCR
PTP2 |
EHP-PTP2-F | GCAGCACTCAAGGAATGGC | [15] |
| EHP-PTP2-R | TTTCGTTAGGCTTACCCTGTGA | ||
| Nested
PCR
EhSWP |
SWP_1F | TTGCAGAGTGTTGTTAAGGGTTT | [5] |
| SWP_1R | CACGATGTGTCTTTGCAATTTTC | ||
| SWP_2F | TTGGCGGCACAATTCTCAAACA | ||
| SWP_2R | GCTGTTTGTCTCCAACTGTATTTGA | ||
| SWP_2F’ | GCAGAGTGTTGTTAAGGGTTTAAG | [16] | |
| SWP_2R’ | GCTGTTTGTCWCCAACTGTATT | ||
Nested PCR
SSU rRNA |
ENF779 | CAGCAGGCGCGAAAATTGTCCA | [21] |
| ENR779 | AAGAGATATTGTATTGCGCTTGCTG | ||
| ENF176 | CAACGCGGGAAAACTTACCA | ||
| ENR176 | ACCTGTTATTGCCTTCTCCCTCC | ||
RPA
SSU rRNA |
F2 | CATTGAGTTTGTTGAGAGTAGCGGAACGGAT | [22] |
| R2 | CTAAGAGCATCGCTTTCGCCTCCGTTGGTC |
3. Các phương pháp phát hiện EHP trong tương lai được đề xuất
Ngoài các phương pháp hiện có, nhiều kỹ thuật chẩn đoán mới nhất khác có thể được sử dụng để phát hiện hiệu quả EHP khi việc đáp ứng nhu cầu chẩn đoán và kiểm soát ngày càng mở rộng trở nên khó khăn hơn. Ví dụ, PCR kỹ thuật số (dPCR), là thế hệ thứ ba của PCR, đang trở nên phổ biến do khả năng định lượng hoàn toàn các tác nhân gây bệnh trong khi vẫn duy trì tính chọn lọc, tính đơn giản, độ chính xác và tốc độ tuyệt vời. Ngoài ra, dPCR góp phần đo mức axit nucleic thấp và khả năng kháng thuốc ức chế, đồng thời cho phép phát hiện tác nhân gây bệnh với độ dung sai bằng không [23]. Hiện nay, dPCR cũng được sử dụng để phát hiện nấm, cho thấy đây là một công cụ có giá trị để phát hiện vi-rút, vi khuẩn, ký sinh trùng, nấm và chlamydia.
Gần đây, một phương pháp PCR kỹ thuật số giọt kép (ddPCR) nhạy và chính xác đã được thực hiện để đồng thời phát hiện và định lượng EHP và bệnh hoại tử gan tụy cấp tính do Vibrio parahaemolyticus (VPAHPND). ddPCR cho thấy độ nhạy cao gấp 10 lần so với qPCR, trong đó mức độ nhạy cảm đối với EHP và VPAHPND lần lượt là 2,3 bản sao/μL và 4,6 bản sao/μL [24]. Do đó, ddPCR được khuyến nghị sử dụng để phát hiện EHP vì dự kiến nó sẽ có lợi cho việc điều tra các mục tiêu bộ gen phức tạp và mở ra kỷ nguyên mới về chẩn đoán bệnh lý.
Giải trình tự thế hệ tiếp theo (NGS) là một kỹ thuật giải trình tự thông lượng cao cung cấp những cách mới để phát hiện vi sinh vật ngoài các phương pháp dựa trên nuôi cấy vi khuẩn [25]. Hơn nữa, NGS có thể được sử dụng để theo dõi những thay đổi của hệ vi sinh vật trong vật chủ động vật và trong môi trường để sử dụng chúng làm dấu hiệu hoặc yếu tố dự báo tình trạng sức khỏe của động vật. Ngoài ra, việc xác định nấm bằng NGS chính xác hơn và dễ tiếp cận hơn vì công nghệ này lý tưởng cho nuôi cấy thù địch và nhiễm trùng do vi khuẩn như nấm. Do đó, có thể đề xuất sử dụng NGS để phát hiện EHP vì nó có thể cung cấp phương pháp quan sát những thay đổi trong hệ vi khuẩn EHP trong suốt thời gian nhiễm trùng và nâng cao kiến thức của chúng ta về cơ chế sinh bệnh của EHP ngoài các tương tác trực tiếp giữa vật chủ và EHP [6].
DNA môi trường (eDNA) là DNA được tìm thấy trong các mẫu môi trường như đất, nước, trầm tích hoặc không khí mà các sinh vật thải ra môi trường thông qua các chất tiết và chất thải như chất nhầy, nước tiểu, máu, giao tử, nước bọt, tế bào da chết, phân, tóc, xác chết, v.v. Ngoài ra, thuật ngữ “DNA môi trường” đề cập đến khả năng chiết xuất axit nucleic của vi khuẩn trực tiếp từ các mẫu môi trường [26]. Công nghệ eDNA gần đây đã được sử dụng rộng rãi như một công cụ khảo sát sinh vật thủy sinh mới để phát hiện loài, đánh giá đa dạng sinh học và xác định số lượng quần thể [27]. Ngoài ra, công nghệ eDNA còn mang lại những lợi ích như lấy mẫu thuận tiện, tiết kiệm chi phí và độ nhạy cao so với các phương pháp truyền thống.
Ngoài ra, các cảm biến sinh học cũng có thể được sử dụng làm phương pháp phát hiện EHP vì chúng tích hợp một thành phần nhận dạng sinh học với một chất báo cáo lý hóa để phát hiện nhiều loại chất phân tích như protein, chất chuyển hóa, DNA, RNA, v.v. [6]. Ví dụ, một cảm biến miễn dịch được thiết kế dựa trên cân vi tinh thể thạch anh (QCM) để phát hiện Vibrio harveyi, nguyên nhân gây bệnh và tử vong ở các trang trại nuôi tôm thương mại, có thể được sử dụng để phát hiện Vibrio harveyi trong phạm vi 103–107 CFU/mL [28]. Tuy nhiên, do vật liệu đắt tiền, tính phức tạp của việc giải thích dữ liệu và độ nhạy với các ma trận sinh học, phương pháp này không được mong muốn.
4. Các biện pháp can thiệp trong việc quản lý EHP
Các khía cạnh quan trọng nhất trong việc quản lý EHP sẽ là các biện pháp an toàn sinh học và thực hành quản lý tốt trong các trang trại. Đầu tiên, đàn giống sạch cung cấp trứng và ấu trùng cho các trại giống phải được mua cẩn thận để ngăn chặn vật mang bệnh xâm nhập vào hệ thống nuôi. Rất nên tuân thủ các quy trình an toàn sinh học nghiêm ngặt và quản lý ao nuôi tôm tốt, chẳng hạn như khử trùng bằng clo, khử clo trong nước, bón vôi, phơi khô và cày xới để ngăn ngừa nhiễm EHP vì rất khó để tiêu diệt bệnh khi bào tử đã có trong ao [4]. Tuy nhiên, việc ức chế sự đùn bào tử có thể là một phương pháp hiệu quả để kiểm soát nhiễm trùng EHP. Sự đùn bào tử EHP có thể bị ức chế bằng cách vô hiệu hóa bào tử khi đun nóng ở 75 °C hoặc đông lạnh ở −20 °C. Hơn nữa, vôi sống (CaO) có thể được sử dụng để xử lý ao trước khi thả giống để đùn bào tử. Điều này là do mức pH thấp đã được chứng minh là có thể vô hiệu hóa bào tử. Trong một nghiên cứu được tiến hành trong đó bào tử được ủ trong đệm ở mức pH là 4, 7 và 9, chúng cho thấy tỷ lệ nảy mầm lần lượt là 5%, 10% và 90% [6].
Hơn nữa, tôm từ các ao nuôi nên được sàng lọc EHP bằng các kỹ thuật phân tử một cách thường xuyên [6]. Cần phải lấy mẫu các phần khác nhau của ao, vì nhiễm trùng có thể không đồng đều. Có thể sử dụng các giao thức eDNA bằng cách lấy mẫu nước và đất từ các ao nuôi tôm để xác nhận sự hiện diện của nhiễm trùng EHP. Kỹ thuật eDNA rút ngắn thời gian liên quan đến việc thu thập và xử lý mẫu vì không cần phải xử lý động vật.
Ngoài ra, việc tăng cường hệ thống miễn dịch của tôm có thể được coi là một phương pháp để kiểm soát các đợt bùng phát dịch bệnh trong nuôi trồng thủy sản. Các chất phụ gia thức ăn có chứa kẽm và selen có thể thúc đẩy sức khỏe miễn dịch của tôm, trong đó kẽm đặc biệt đẩy nhanh quá trình chữa lành vết thương. Hơn nữa, tôm, là động vật không xương sống, chủ yếu phụ thuộc vào hệ thống miễn dịch bẩm sinh của chúng để chống lại các bệnh xâm nhập như bệnh vi bào tử trùng gan tụy (HPM), bệnh hoại tử gan tụy cấp tính (AHPND), v.v. Do đó, việc phát triển trí nhớ miễn dịch bẩm sinh xuyên thế hệ ở tôm có thể cho phép sản xuất ra thế hệ con có khả năng chống lại các bệnh truyền nhiễm tốt hơn. Việc tiếp xúc sớm hơn với vi khuẩn sống hoặc đã chết hoặc protein vi-rút đã được chứng minh là cải thiện khả năng bảo vệ trong quá trình nhiễm trùng thứ cấp và tăng tỷ lệ sống sót ở tôm [29]. Gần đây, một nghiên cứu đã được tiến hành bằng cách tạo ra trí nhớ miễn dịch bẩm sinh xuyên thế hệ chống lại nhiễm trùng Vibrio trong mô hình tôm ngâm nước muối (Artemia franciscana) trong đó một thế hệ cha mẹ được tiếp xúc với Vibrio parahaemolyticus PV1 sống hoặc đã chết, và một thế hệ cha mẹ khác được tiếp xúc với Vibrio campbellii LMG2136 sống hoặc đã chết. Người ta báo cáo rằng con cái của cha mẹ F0 được mồi đã biểu hiện trí nhớ miễn dịch bẩm sinh so với con cái của cha mẹ F0 đối chứng không được mồi vì chúng có khả năng phòng vệ đáng kể chống lại các bệnh nhiễm trùng Vibrio trong tương lai [29]. Do đó, việc nâng cao khả năng miễn dịch được huấn luyện ở tôm có thể cung cấp hỗ trợ quan trọng để kiểm soát bệnh tật và phát triển nuôi trồng thủy sản bền vững.
Hơn nữa, vắc-xin và thuốc kích thích miễn dịch là các biện pháp phòng ngừa được sử dụng để tăng cường hệ thống miễn dịch của vật chủ. Trong trường hợp này, tôm phải dựa vào hệ thống miễn dịch bẩm sinh của chúng vì chúng không có hệ thống miễn dịch thích ứng. Do đó, việc tạo ra vắc-xin cho chúng rất tốn thời gian, tốn kém và tẻ nhạt. Trong khi đó, thuốc kích thích miễn dịch là các hóa chất kích thích hiệu quả hệ thống phòng thủ không đặc hiệu của vật chủ để chống lại các vi sinh vật xâm nhập. Do đó, thuốc kích thích miễn dịch có thể là một phương pháp tiếp cận đầy hứa hẹn để quản lý sức khỏe tôm, vì chúng bù đắp cho sự khác biệt trong việc sử dụng vắc-xin và đưa ra giải pháp hợp lý về mặt miễn dịch của tôm [30]. Thuốc kích thích miễn dịch được ưa chuộng hơn so với tiêm kháng sinh vào tôm vì sự khuếch đại sinh học và tích tụ sinh học của dư lượng kháng sinh trong chuỗi thức ăn và lưới thức ăn có thể gây dị ứng, ngộ độc và kháng thuốc ở người. Việc sử dụng chất kích thích miễn dịch không gây ra tác động tiêu cực đến môi trường vì không tích tụ chất độc hại và cũng dễ dàng sử dụng chất kích thích miễn dịch cho ấu trùng và tôm. Nhìn chung, phòng ngừa và kiểm soát bệnh ở tôm đều cần một chiến lược tích hợp trong đó chúng ta phải nâng cao hiểu biết về khả năng miễn dịch của tôm.
Hơn nữa, tôm bị nhiễm bệnh có thể truyền EHP cho người và gây bệnh. Để hiểu rõ hơn về vòng đời, khả năng gây bệnh, phản ứng miễn dịch của vật chủ và bệnh lý học của nhiễm trùng nấm, có thể sử dụng các công cụ chỉnh sửa gen như CRISPR-Cas và can thiệp RNA (RNAi). Chỉnh sửa bộ gen đã cải thiện khả năng hiểu cách di truyền ảnh hưởng đến bệnh tật bằng cách thúc đẩy sự phát triển của các mô hình tế bào và động vật chính xác hơn về các quá trình bệnh lý [31].
Sự phát triển của công cụ CRISPR/Cas là một sự bổ sung hữu ích cho công nghệ chỉnh sửa gen đối với nấm gây bệnh, đặc biệt là ở các loài nấm lưỡng bội không có giảm phân và plasmid chuyển gen [32]. Điều này là do CRISPR/Cas đã phát triển thành một công cụ sinh học phân tử và công nghệ sinh học đột phá cho phép chúng ta thực hiện chính xác các quá trình phát hiện axit nucleic, điều hòa biểu hiện gen, chỉnh sửa hệ gen, biểu sinh và chỉnh sửa RNA trong nhiều loại sinh vật. Việc sử dụng nhiều loại vectơ và phức hợp sgRNA/Cas9 khác nhau để đưa các thành phần của hệ thống CRISPR vào tế bào nấm giúp có thể sửa đổi biểu hiện gen ở nhiều loài nấm [33].
Trong lĩnh vực công nghệ sinh học, chỉnh sửa chính là kỹ thuật chỉnh sửa gen mới nhất được phát triển, kỹ thuật này xác định vị trí và sửa đổi các điểm trong gen cần được sửa đổi mà không làm hỏng DNA sợi đôi tại điểm mục tiêu [33]. Ngoài ra, nhiều nghiên cứu đang được tiến hành để phát triển các loại thuốc chống nấm mới vì nấm gây bệnh có thể gây nhiễm trùng ở người bị suy giảm miễn dịch do HIV, ghép tạng, hóa trị ung thư, v.v. [34,35]. Nhìn chung, kiến thức về các biện pháp can thiệp này có thể được áp dụng để ngăn ngừa nhiễm trùng EHP trong nuôi tôm nhằm đảm bảo an toàn thực phẩm.
5. An toàn thực phẩm
Các kỹ thuật phát hiện EHP đã đề cập ở trên rất quan trọng để phân biệt giữa tôm khỏe mạnh và tôm bị bệnh nhằm đảm bảo an toàn thực phẩm trong quá trình tiêu thụ ở hạ nguồn. Những người bị suy giảm miễn dịch và suy giảm miễn dịch, chẳng hạn như bệnh nhân AIDS, dễ bị nhiễm EHP vì nó có quan hệ gần với Enterocytozoon bieneusi, một loài được biết là có thể lây nhiễm cho bệnh nhân AIDS. Mặc dù thiếu bằng chứng cho thấy EHP lây nhiễm cho các loài động vật khác ngoài tôm, việc phát hiện EHP ở tôm là rất quan trọng đối với sức khỏe con người [15]. Nguyên nhân là do tôm bị nhiễm bệnh không biểu hiện triệu chứng lâm sàng rõ ràng trong thời gian ngắn và tôm khỏe mạnh có thể bị nhiễm EHP do chung sống với tôm bị bệnh. Ngoài ra, các xét nghiệm sinh hóa và phân tích 16S rRNA được đề xuất là phương pháp chẩn đoán thích hợp để xác định những thay đổi của hệ vi sinh vật đường ruột tôm và tình trạng sức khỏe nhằm đảm bảo an toàn thực phẩm [36]. Do đó, việc phát triển một phương pháp tiếp cận hiệu quả để phát hiện nhiễm EHP ở tôm, đặc biệt là trong giai đoạn đầu của quá trình nhiễm trùng là rất quan trọng.
Các nghiên cứu gần đây cho thấy các bệnh nhiễm trùng do vi-rút ngoại lai có thể lây truyền sang tôm nuôi thông qua các sản phẩm tôm đông lạnh được chế biến và đóng gói để tiêu thụ cho con người. Tuy nhiên, có báo cáo rằng không có bằng chứng dịch tễ học nào trong các tài liệu khoa học hoặc trong các cơ sở dữ liệu công khai chỉ ra rằng các đợt bùng phát bệnh tôm ở các trang trại hoặc trong nghề cá tự nhiên là do tôm chế biến và đóng gói để tiêu thụ cho con người [37]. Mặc dù không có bằng chứng nào cho thấy bệnh nhiễm trùng tôm lây truyền sang người tiêu thụ, nhưng người ta cho rằng nên thực hiện các bước phòng ngừa để đảm bảo an toàn thực phẩm. Do đó, điều quan trọng là phải điều tra các con đường lây truyền EHP trong chuỗi thực phẩm tôm-con người để đánh giá tính an toàn của chuỗi thực phẩm [15].
Hướng dẫn có hệ thống về an toàn thực phẩm cho tôm
Việc tuân thủ các hướng dẫn có hệ thống về an toàn thực phẩm cho tôm là rất quan trọng để đảm bảo rằng ngành nuôi trồng thủy sản sản xuất ra thực phẩm an toàn để tiêu dùng. Có năm khía cạnh quan trọng của phương pháp tiếp cận chuỗi thực phẩm đối với an toàn thực phẩm [38]. Đầu tiên, an toàn thực phẩm phải được kết hợp với phân tích rủi ro, bao gồm đánh giá rủi ro, quản lý rủi ro và truyền đạt rủi ro. Phân tích rủi ro bao gồm việc xác định các yếu tố gây ra có khả năng gây ra tác động xấu đến sức khỏe có thể có trong các sản phẩm nuôi trồng thủy sản. Các tác nhân gây ra bao gồm các tác nhân sinh học như vi khuẩn, vi-rút, nấm và các tác nhân hóa học như thuốc trừ sâu. Ví dụ, vi khuẩn như Vibrio parahaemolyticus, Vibrio cholerae, Vibrio vulnificus, Salmonella sp. và các loại vi-rút như norovirus và vi-rút viêm gan A có thể được tìm thấy trong động vật thân mềm có vỏ, động vật có vỏ, cá và các sản phẩm nuôi trồng thủy sản khác. [38].
Chuyển sang quy trình tiếp theo, đánh giá rủi ro bao gồm việc ghi lại các nguồn gây ô nhiễm, tần suất và nồng độ của chúng cũng như đánh giá khả năng và nồng độ có thể xảy ra khi chúng được tiêu thụ. Thông tin về tác nhân gây bệnh và thực phẩm, bao gồm sự hiện diện của vi khuẩn, mức độ pH, hàm lượng dinh dưỡng và cuối cùng là thói quen tiêu thụ thực phẩm của người tiêu dùng, được sử dụng để thực hiện quy trình này. Tiếp theo, xác định các giải pháp quản lý khả thi, lựa chọn phương án tối ưu, xem xét các tiêu chuẩn an toàn có liên quan và đưa ra quyết định quản lý cuối cùng đều là một phần của quản lý rủi ro. Trong trường hợp này, cần phải tối đa hóa hiệu quả, hiệu suất, khả năng công nghệ và tính thực tiễn của các biện pháp kiểm soát thực phẩm ở các giai đoạn khác nhau của chuỗi thực phẩm. Hơn nữa, tất cả các khía cạnh giao tiếp giữa người đánh giá rủi ro, người quản lý rủi ro và công chúng đều được đưa vào ứng dụng thực tế của truyền thông rủi ro liên quan đến an toàn thực phẩm. Mục tiêu cuối cùng của truyền thông rủi ro là chia sẻ kiến thức, thái độ, niềm tin, thực hành và quan điểm của các bên quan tâm liên quan đến mối nguy hiểm khi ăn một số loại thực phẩm nhất định và các vấn đề liên quan khác.
Tiếp theo, khía cạnh truy xuất nguồn gốc từ nhà sản xuất chính đến khâu chế biến thực phẩm và phân phối đến tay người tiêu dùng cần được tăng cường. Hơn nữa, để đạt được mức độ bảo vệ tương đương chống lại các rủi ro do thực phẩm, các tiêu chuẩn an toàn thực phẩm phải được chuẩn hóa và các hệ thống an toàn thực phẩm phải tương đương. Cuối cùng, việc trao quyền quản lý an toàn thực phẩm đòi hỏi phải chú trọng hơn vào việc phòng ngừa rủi ro ngay từ nguồn trong toàn bộ chuỗi thực phẩm từ trang trại đến bàn ăn. Phòng ngừa rủi ro trong nuôi tôm chủ yếu có thể được thực hiện bằng cách thả tôm giống từ một đàn giống không có mầm bệnh cụ thể, giúp giảm thiểu tác động của bệnh tật như một biện pháp an toàn sinh học và kiểm soát dịch bệnh [39].
Một nghiên cứu do Trung tâm An toàn Thực phẩm (CFS) tại Hồng Kông thực hiện đã chỉ ra rằng các trường hợp ngộ độc thực phẩm là do các sinh vật gây bệnh như Vibrio parahaemolyticus và Salmonella sp., được xác định có trong sashimi tôm sống và các loại thực phẩm khác. Do đó, đã được chứng minh rằng thực phẩm sống có nguy cơ mang các sinh vật như vậy cao hơn và nấu chín kỹ hải sản là cách tốt nhất để giảm thiểu nguy cơ mắc bệnh do thực phẩm bằng cách loại bỏ các vi sinh vật gây bệnh có trong hải sản. Những người có hệ miễn dịch suy yếu, phụ nữ mang thai, bà mẹ cho con bú và người cao tuổi nên tránh ăn động vật có vỏ sống hoặc chế biến không đúng cách vì họ dễ bị nhiễm trùng do thực phẩm do hệ miễn dịch suy yếu [40]. Điều này cũng áp dụng cho các loại thực phẩm có nguy cơ nhiễm EHP vì ăn thực phẩm có tôm sống, chẳng hạn như sushi, bị nhiễm EHP có thể ảnh hưởng tiêu cực đến sức khỏe con người vì EHP có thể lây truyền sang cơ thể người và gây bệnh. Nhiễm ký sinh trùng ở người có thể gây ra nhiều dạng rối loạn tiêu hóa như tiêu chảy mãn tính, đầy hơi, đầy hơi, buồn nôn và hấp thụ dinh dưỡng kém dẫn đến sụt cân [41]. Mặc dù rối loạn tiêu hóa là triệu chứng điển hình nhất của nhiễm ký sinh trùng, nhưng chúng cũng có thể lây nhiễm vào bất kỳ hệ cơ quan nào và dẫn đến viêm giác mạc, viêm cơ, viêm xoang và viêm não [41]. Do đó, việc điều tra EHP và tác động của nó đối với an toàn thực phẩm là điều cơ bản vì vấn đề này hiếm khi được đề cập đến.
6. Kết luận
Tóm lại, EHP đã phát triển thành một trong những bệnh nhiễm trùng quan trọng nhất ở Châu Á, gây ra HPM ở tôm chân trắng nuôi Penaeus vannamei [6]. Bệnh tôm có tác động đáng kể đến hoạt động nuôi tôm và tính bền vững của sản xuất phụ thuộc vào sự cân bằng giữa môi trường, phòng ngừa bệnh thông qua chẩn đoán mầm bệnh và khảo sát dịch tễ học, và sức khỏe tôm [4]. Vì hiện tại vẫn chưa có phương pháp điều trị EHP nên phòng ngừa là biện pháp phòng ngừa tốt nhất chống lại EHP, đặc biệt là khi chưa có liệu pháp hiệu quả về mặt chi phí, quy mô trang trại. Nhìn chung, nghiên cứu này sẽ hỗ trợ việc hiểu biết về EHP và chẩn đoán cũng như các phác đồ điều trị để kiểm soát EHP, góp phần nâng cao chất lượng môi trường và an toàn thực phẩm. Do đó, cần phải tuân thủ các hướng dẫn và quản lý thích hợp trong các hệ thống nuôi tôm và cần nghiên cứu sâu rộng về chẩn đoán nhiễm EHP để đảm bảo an toàn thực phẩm và ngăn ngừa sự lây truyền EHP sang người.
Lời cảm ơn
Công trình này được hoàn thành với nguồn tài trợ từ Khoản tài trợ hợp tác quốc tế ST052-2022 UM do Trung tâm nghiên cứu công nghệ sinh học cho nông nghiệp (CEBAR), IPPP, Đại học Malaya trao cho S.B. URL: https://cebar.um.edu.my/ (truy cập ngày 2 tháng 3 năm 2023).
BQQ dịch từ nguồn: https://pmc.ncbi.nlm.nih.gov/articles/PMC10820212/?fbclid=IwZXh0bgNhZW0CMTEAAR1BSGKZO92T8SxntssNdAurMSERqyCONrEnN2srXF31bdCsYYwxCTa7iTo_aem_DSgHqiUAY6txcHIgRNRaHw





